LA CONFIGURACIÓN ELECTRÓNICA
El conocimiento de la distribución de los
electrones en los distintos orbitales es muy importante para entender las
propiedades de los átomos. Esta información se expresa mediante la configuración electrónica.
Se llama
configuración electrónica de un átomo al modo en que están distribuidos los
electrones alrededor del núcleo de ese átomo.
Para
realizar la configuración electrónica de un átomo, los orbitales se representan
de la siguiente forma:
ESTADO BASAL Y ESTADO EXCITADO DE UN ÁTOMO
En un átomo en estado normal (también llamado estado fundamental o estado basal), los electrones se
ubican lo más cerca que pueden del núcleo, siempre de forma ordenada. (Es el
estado en el que los electrones de un átomo consumen la menor cantidad de
energía posible) .Cuando un átomo está excitado quiere decir que
ha absorbido energía y sus electrones se han movido a un nivel de mayor energía
(se han alejado del núcleo).
PRINCIPIOS FUNDAMENTALES DE DISTRIBUCIÓN
PROBABLE DE ELECTRONES.
Es
posible expresar la configuración electrónica probable de cualquier átomo de un
elemento en su estado basal ,considerando
el número máximo de electrones por orbitales,
subniveles y niveles de energía
así como
los siguientes principios:
- PRINCIPIO DE EXCUSIÓN DE PAULI
- REGLA DE HUND O PRINCIPIO DE LA
- MÁXIMA MULTIPLICIDAD ELECTRÓNICA
- PRINCIPIO DE EDIFICACIÓN PROGRESIVA O REGLA DE AUF – BAU
PRINCIPIO
DE EXCUSIÓN DE PAULI
Establece
que no es posible que dos electrones en el mismo átomo tengan sus cuatro
números cuánticos iguales es decir que en un orbital solo puede
haber como máximo 2 electrones
siempre que tengan spin opuesto.
REGLA DE
HUND O PRINCIPIO DE LA MÁXIMA MULTIPLICIDAD ELECTRÓNICA
Cuando una serie de orbitales de igual energía (p, d , f) se están
llenando con electrones, éstos permanecerán desapareados mientras sea posible,
manteniendo los espines paralelos
PRINCIPIO
DE EDIFICACIÓN PROGRESIVA O REGLA DE AUF – BAU.
Este principio establece
que al realizar la configuración electrónica de un átomo cada
electrón ocupará el orbital disponible de mínima energía.
Este principio
también se conoce como regla de las diagonales, considerando las energías
relativas de los orbitales de un átomo poli electrónico el orden de llenado de
orbitales se podrá determinar por la siguiente figura siguiendo las líneas
diagonales:
De acuerdo
con la figura anterior el orden de ocupación progresiva será:
1s, 2s, 2p, 3s, 3p, 4s, 3d,
4p, 5s, 4d, 5p, 6s, 4f, 5d,
6p, 7s, 5f, 6d, 7p
ejemplo: calcula los cuatro números cuánticos del
orbital: 4d6
Ahora haz tú los siguientes ejercicios:
- 2Calcular los 4 números cuánticos de 3p5
- 3Calcular los 4 números cuánticos de 4d3
- 4Calcular los 4 números cuánticos de 6f7
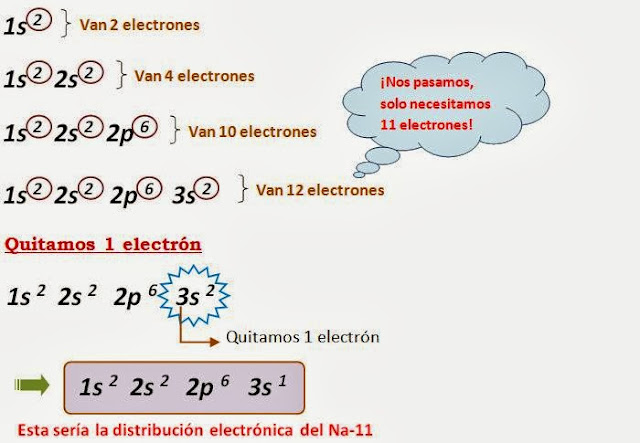
Procederemos a distribuir los 11 electrones según la tabla
Ahora haz tú la configuración electrónica de los siguientes elementos
1) 6C
2) 35Br
3) 20Ca
4) 79Au
SIMULADOR ORDEN DE LLENADO DE LOS ORBITALES
NOTAS:
1. Configuración
Electrónica abreviada
El
método del Kernel,
es una abreviación de la configuración de un gas noble. Los gases nobles son:
helio (2He),
neón (10Ne),
argón (18Ar),
kriptón (36Kr),
xenón (54
Xe) y radón (86Rn).
Para enterderlo, nos ayudaremos de la tabla periódica de la página 207 del libro de texto
Así por ejemplo, la configuración electrónica abreviada del 13Al sería:
13Al
: [10Ne] 3s2 3p1
2. Electrones de valencia
Se llaman electrones de valencia a los electrones responsables del comportamiento químico de los átomos. Son los electrones situados en el último nivel. Por ejemplo, en el ejemplo anterior, vemos que el nivel de valencia del átomo de alumnio es el 3. En él hay 3 electrones de valencia (3s2 3p1).
Averigua el nivel de valencia de
De los electrones de valencia dependen las propiedades de los elementos y los compuestos químicos que forman, puesto que son los electrones que intervienen en los procesos químicos.
Los gases nobles tienen su último nivel completo: no caben en él más electrones. Por ello decimos que tienen 8 electrones de valencia, a excepción del helio, que tiene 2.
3. Valencia de un elemento
La valencia de un elemento es la capacidad que tiene para combinarse con otro.
Los gases nobles tienen valencia cero, pues tienen completo su último nivel de electrones, lo que les da gran estabilidad y por eso sus átomos no se combinan. Los demás elementos tienden a alcanzar la configuración de un gas noble, por eso sus átomos se combinan con una valencia que depende del número de electrones que tienen en su último nivel
SIMULADOR ORDEN DE LLENADO DE LOS ORBITALES
SIMULADOR ORDEN DE LLENADO DE LOS ORBITALES

.jpg)
.jpg)
.jpg)


.jpg)
.jpg)
.jpg)














.jpg)



No hay comentarios:
Publicar un comentario